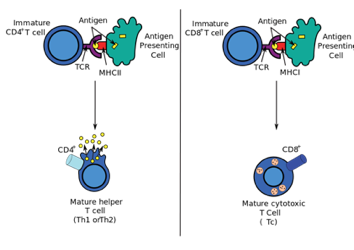
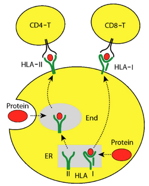
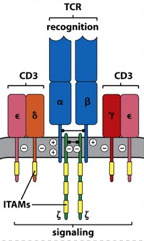
1. PBRM1基因失活突变的患者更容易从免疫检查点抑制剂治疗中获益。
研究者在肾透明细胞癌患者队列中发现PBRM1基因功能失活突变与抗PD-1治疗获益显著相关,PBRM1基因失活突变的患者OS和PFS显著延长。
肾透明细胞癌是一种相对特殊的肿瘤,与非小细胞肺癌(NSCLC)、黑色素瘤或微卫星不稳定的结直肠癌相比,肾透明细胞癌的突变负荷很小。黑色素瘤和非小细胞肺癌的突变负荷通常在 10 - 400 突变/Mb 之间,而肾透明细胞癌平均突变负荷只有 1.1 突变/Mb,但部分肾透明细胞癌患者可以从Nivolumab 治疗中获益。
此外,肾透明细胞癌在肿瘤微环境中免疫杀伤活性、免疫浸润程度和细胞毒性 T 细胞浸润程度上较其他肿瘤更高。鉴于肾透明细胞癌的这些特征,研究者猜测肾透明细胞癌活化的免疫微环境和对免疫检查点抑制剂治疗的应答背后可能有某种独特的分子机制。
PBRM1 基因失活突变会上调 JAK/STAT 通路、低氧通路和免疫信号通路基因的表达,这可能是 PBRM1 缺陷患者从抗 PD-1 治疗获益的分子机制。
Genomic correlates of response to immune checkpoint therapies in clear cell renal cell carcinoma. Science 04 Jan 2018 10.1126/science.aan5951
Kidney cancer: PBRM1 loss promotes tumour response to immunotherapy. Nature Reviews Nephrology. 22 January 2018 10.1038/nrneph.2018.7
2. 血常规 & 肝功检测
血常规中的中性粒细胞与其他白细胞的比值dNLR【中性粒细胞数/(白细胞-中性粒细胞数)】大于3,肝功能里的
乳酸脱氢酶LDH超过正常值,意味着PD-1抑制剂的疗效打折扣。
- Association of the Lung Immune Prognostic Index With Immune Checkpoint Inhibitor Outcomes in Patients With Advanced Non-Small Cell Lung Cancer. JAMA Oncol. 2018 Jan 11. doi:10.1001/jamaoncol.2017.4771.
3. 三大主流PD1,到底怎么选?
目前上市了的五个PD-1/PD-L1抑制剂,到底应该选择哪一个?
这个问题,有三种答案:
第一种,是最官方、最正宗、最滴水不漏的答案:看说明书、看指南、看FDA批文。
比如,你是晚期非小细胞肺癌患者,未经过任何治疗,打算选择PD-1抑制剂联合化疗,那么你应该选择K药,因为这种场景下,只有K药联合化疗获得了正式的批准。
比如,你是肝癌,做过手术、射频、介入,也吃过多吉美,现在有点耐药了,想试一试PD-1抗体,那么你应该选择O药,因为截至目前只有O药被正式批准用于肝癌的二线治疗。
再比如,你得了一种非常罕见的癌症,Merkel细胞癌,你再发愁应该怎么治,结果医生或者病友告诉你一个好消息,可以试一试PD-1抑制剂呀,那么你应该选择的是B药(avelumab),应该只有这个药是正式批准用于Merkel细胞癌的……
第二种,最调侃的、但其实不乏智慧的答案:抛骰子决定吧!
很多病友及其家属,会为了一些细枝末节的问题,纠结很久很久,甚至耽误了治疗。而往往这类病人还不愿意“轻信”医生的建议,喜欢网上东查查西看看,喜欢各个专家都问一问“货比三家”,到最后越搞越纠结、越来越焦虑——那么,这类病人,其实就适合“听从上天的旨意”,抛骰子吧。
第三种,最实用、最接地气的回答:从目前已有的临床试验数据以及国内外专家的经验判断,这几种药物差异很小,建议根据身高体重换算,哪个便宜就用哪个。
近期,一项纳入了3024名接受PD-1抑制剂治疗的晚期肺癌患者的荟萃分析,再一次证实了这一点。
这项荟萃分析,一个纳入了5个直接比较PD-1抑制剂(K药、O药或T药)对比多西他赛化疗,治疗晚期非小细胞肺癌的临床试验。结果显示:在未经选择的人群中,PD-1抑制剂相比于化疗,平均延长了2-4个月的总生存期,疾病进展和患者死亡的风险降低了30%。其中PD-L1阳性的患者,获益更大,其疾病进展和死亡的风险降低了55%-60%。
此外,该研究还横向比较了3种PD-1抑制剂治疗肺癌的疗效,结果再一次提示,没有统计学差异,疗效差别很小。而且,不管是在PD-L1表达未经选择,还是PD-L1表达超过1%、超过5%、超过50%的亚组里,三者的疗效均无统计学差异。
4. 肿瘤免疫治疗
4.1 背景介绍
不同于以往直接靶向肿瘤细胞或者通过控制血管生长试图饿死肿瘤的靶向治疗药物,肿瘤免疫治疗是通过调节肿瘤微环境、固有免疫系统和靶向T细胞,最终依靠自身免疫系统来清除肿瘤。
如果把1984年,美国国立癌症研究院史蒂夫·罗森伯格(Steve Rosenberg)团队成功地用高剂量白细胞介素2(IL-2)治愈第一例病人,算作肿瘤免疫治疗的开端。那么直到2011年Anti-CTLA-4抗体药物Ipilimumab在美国被批准上市用来治疗恶性黑色素肿瘤,才真正意义上拉开了肿瘤免疫治疗的序幕。2014年Anit-PD-1单抗迎来收获季,默沙东的Keytruda和BMS的Opdivo相继在美国上市,显著的治疗效果使二者迅速揽下黑色素瘤(Keytruda/Opdivo)、NSCLC(Keytruda/Opdivo)、头颈癌(Keytruda/Opdivo)、肾细胞癌(Opdivo)和经典型霍奇金淋巴瘤(Opdivo)五个适应症。2017年伊始,Opdivo第六大适应症膀胱癌也被FDA批准,Keytruda用于一线和二线治疗晚期或转移性尿路上皮癌的sBLA也同时被FDA受理,并被双双授予优先审评资格。
无论PD-1/PD-L1和CTLA-4抑制通路还是激活T细胞的OX40等通路的治疗性抗体,发挥作用的前提是:病人体内必须有足够的针对肿瘤细胞的特异性T细胞这个重型武器。
4.2 治疗思路
人体对抗肿瘤的终极武器就是特异性T细胞。所以要想在Anti-PD1/PD-L1等免疫检查点抗体扣动扳机时能瞄准并杀掉肿瘤细胞,就必须保证体内有足够的特异性T细胞。理想的抗肿瘤免疫治疗的核心便是:提供抗肿瘤武器弹药(特异性T细胞),及时运输到合适的场地(肿瘤微环境)并扣动扳机(Anti-PD1/PD-L1抗体)杀掉肿瘤细胞。
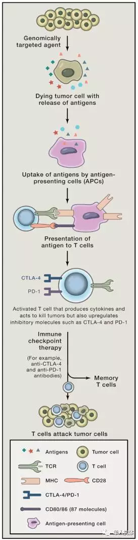
- nature medicine 24 October 2016; doi:10.1038/nm.4200
- Cell Volume 161, Issue 2, p205–214, 9 April 2015
4.2.1 肿瘤免疫治疗思路 - 直接补充抗肿瘤弹药
很多肿瘤患者治疗失败的主因就是体内缺少针对肿瘤细胞的特异性T细胞,因此简单有效的直接补充特异性T细胞就成为一种顺其自然的策略,主要有CAR-T细胞治疗和bispecific antibody两种方式。
Bispecific antibody因自身的结构优势,可以作为连接器,把T细胞特异性引导到肿瘤细胞处,通过Anti-CD3抗体部分诱发T细胞对肿瘤细胞进行杀伤。现在已有两个产品上市:2009年第一个产品Catumaxomab上市(又被成为三功能抗体),Catumaxomab是小鼠和大鼠抗体杂交抗EpCAM/CD3抗体,治疗恶性腹水患者;2014年12月,Amgen的Blinatumomab(商品名:Blincyto)上市,用于治疗费氏染色体阴性的前体B细胞急性淋巴细胞白血病。
另一种更直接补充弹药的方式便是CAR-T细胞治疗,CAR-T自问世之初便成功吸引众多眼球,尽管kite 已于2016年12月就其CAR-T疗法项目KTE-C19向FDA提交了上市注册申请。但是近期,Juno决定终止JCAR015这个先导项目,主要是由于超出预期的毒性,导致5例病人因出现脑水肿或脑肿胀而死亡。联想到去年诺华解散细胞治疗团队,似乎对CAR-T细胞治疗的预期有所下降。
4.2.2 肿瘤免疫治疗思路 - 调节固有免疫系统,自主生产抗肿瘤弹药
在抗肿瘤免疫中,首先需要人体固有免疫系统对肿瘤细胞进行识别并呈递给获得性免疫系统,才能产生肿瘤特异性T细胞.
如果能有效激活体内固有免疫,通过固有免疫来监视肿瘤细胞,并迅速反馈给获得性免疫系统,这不仅可以保证体内有持续足够的特异性T细胞,而且将使突变的肿瘤细胞也无处可藏。
作为人体固有免疫系统和获得性免疫系统衔的主要环节,巨噬细胞和DC(树突状细胞)抗原呈递细胞获得了重点的关注。
DC细胞作为更专职的抗原呈递细胞,一直是肿瘤疫苗的首选。
- Cell Research (2017) 27:74–95. doi:10.1038/cr.2016.157
4.2.3 肿瘤免疫治疗思路 - 肿瘤微环境调节
无论是直接补充特异性T细胞,还是通过固有免疫系统的调节来使人体持续产生特异性T细胞,只有T细胞有效迁移到肿瘤部位,并且在肿瘤微环境中仍然维持活性,才能有效的清除肿瘤细胞。
可以通过CXCR4或者VEGF/VEGFR等抑制剂来提高T细胞向肿瘤组织的迁移;此外IDO、CXCR2等抑制剂也可以通过对微环境的调节提高CTLA-4和PD-1/PD-L1抑制剂的作用。
- Science 03 Apr 2015: Vol. 348, Issue 6230, pp. 74-80 DOI: 10.1126/science.aaa6204
4.3 T细胞免疫疗法
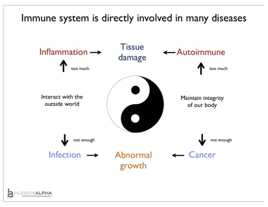
4.4 基本原则
肿瘤免疫治疗的基本原则有二:
一是免疫反应调节(免疫激动、免疫刺激和免疫修饰等)。
二是直接使用免疫相关细胞因子。
肿瘤主动免疫治疗的根本思想就是用肿瘤抗原在体内激发机体自身的免疫保护机制,从而达到治疗肿瘤或预防复发的作用。
主动治疗有以下几个特点:
通过主动免疫能够激发全身性的抗肿瘤效应,与手术、放疗相比,作用范围更加广泛,特别适用于多发病灶或有广泛转移的恶性肿瘤;
主动免疫治疗通过调动机体自身的力量达到抗肿瘤作用,与放疗和化疗相比,副作用很小;
由于部分肿瘤表达的抗原是自身组织的正常成分,所以用该抗原进行主动免疫可能打破自身免疫耐受而导致自身免疫性疾病的发生。
根据主动免疫所采用的抗原及免疫方式,将其分为以下几种:
肿瘤细胞疫苗,以完整的肿瘤细胞作为肿瘤抗原的来源,通过不同方式进行修饰后用作疫苗。
多肽疫苗,T细胞在机体抗肿瘤作用中具有很重要的作用,而T细胞识别的肿瘤抗原是由MHC分子呈递的抗原性多肽分子,这些具有免疫原性的多肽分子即为多肽疫苗。
表达肿瘤抗原的重组病毒和DNA疫苗,这种建立在迅速发展的分子生物学基础上的肿瘤疫苗,是以某些病毒或质粒DNA作为载体,直接在体内表达相关肿瘤抗原。
APC为基础的肿瘤疫苗或称为APC疫苗,此类肿瘤疫苗的理论基础是APC的抗原呈递功能。
独特型与抗独特型疫苗。
细胞因子基因转导的肿瘤疫苗。
MHC和B7分子转基因的肿瘤疫苗。
非特异性主动免疫治疗 是指应用一些免疫调节剂通过非特异性地增强机体的免疫功能,激活机体的抗肿瘤免疫应答,以达到治疗肿瘤的目的。在非特异的主动免疫治疗中,常用各种细菌菌苗,包括卡介苗(BCG)、短小棒状杆菌菌苗等。还有免疫因子,如转移因子、免疫核糖核酸等。
特异性主动免疫治疗 主动免疫治疗是调动宿主自身的抗肿瘤免疫机制,可采用"瘤苗"给患者接种以诱导特异性肿瘤免疫反应。目前治疗用的瘤苗主要有肿瘤细胞瘤苗、基因工程疫苗、抗独特型抗体瘤苗、抗原提呈细胞为基础的瘤苗。
被动免疫治疗是指给机体输注外源的免疫效应物质,由这些外源的效应物质在机体发挥治疗肿瘤的作用。其主要是利用高度特异性的抗体作为载体,将细胞毒性物质靶向性地携至肿瘤病灶局部,可以比较特异地杀伤肿瘤。
过继免疫治疗(adoptive immuno-therapy, AIT)是取对肿瘤有免疫力的具有抗肿瘤活性的细胞输给患者,或取患者自身的免疫细胞在体外活化、增殖后再转输入患者体内,使其在患者体内发挥抗肿瘤作用。过继免疫治疗的效应细胞具有异质性,如CTL、NK细胞、巨噬细胞、淋巴因子激活的杀伤细胞(lymphokine-activated killer cells, LAK)和肿瘤浸润性淋巴细胞(tumor-infiltrating lymphocytes, TIL)等都在杀伤肿瘤细胞中起作用。
4.5 CIK、DC-CIK:欧美已经淘汰十多年
CIK(cytokine induced-killer cells)、DC-CIK技术,大致的过程:把病人的外周血抽出来,然后把其中的一种或几种淋巴细胞分离出来,在体外进行培养,让它们“生儿育女”,成百上千倍地扩增,然后回输给肿瘤患者。
这类肿瘤治疗技术,发端于上世纪80年代初,美国癌症研究中心的Steven Rosenberg教授和斯坦福大学的Irving Weissman教授做出了很大的贡献。
目前,没有充分的证据表明,患者接受了此类治疗,一定能延长生存时间。所以,十几年前,欧美国家已经基本停止了此类技术的研究和应用,遗憾的是,我国(包括台湾)以及我们的近邻——日本和韩国,相关业务开展地如火如荼。“魏则西事件”
CIK、DC-CIK等技术为什么会失败呢?原因主要有两个方面:
血液里的淋巴细胞,大多都是新兵,从来没有见过癌细胞,没有经过战争的洗礼,不知道怎么打癌细胞;
淋巴细胞的内部,也有“叛徒”和“内奸”,不加区别地给它们提供“好吃好喝”的,“帮倒忙”的免疫抑制性细胞也会趁机发展壮大起来
4.6 TIL:始于恶性黑色素瘤的探索
TIL(tumor infiltrating cells)技术:直接从手术切下来的肿瘤组织中分离淋巴细胞,对它们进行杀伤肿瘤能力的测试,将其中杀伤能力最强的部分,给它们“好吃喝好”的,扩增到一定的数目,然后回输给患者——这个方法,相当于直接从战场拉回有战斗经验的老兵,经过一轮“政治审查”和业务能力“大比武”,把内奸、叛徒尽量剔除出去,把战斗能力最强的挑选出来,提供给它们优质的补给,重新送回战场。
与此同时,为了最大限度地把病人体内已有的起反作用的免疫抑制性的淋巴细胞清除掉,一般都会在回输前,利用大剂量化疗或放疗,对病人进行预处理,以提高疗效。
这种预处理,如果不在经验丰富的临床医生密切观察下实施,有可能发生致命的风险。
国内的相关机构,为了尽可能地降低风险,少惹麻烦,开展肿瘤免疫细胞治疗时,几乎从来不做预处理,这也是治疗效果大打折扣的原因之一。
截止到目前,欧美已有数百例晚期恶性黑素瘤患者接受了TIL治疗,其中50%左右的患者有效果,20%左右的患者肿瘤完全消失,肿瘤完全消失的患者大部分疗效持久,少数患者甚至已经健康存活了十几年。遗憾地是,TIL技术操作相对复杂,疗效目前仅限于恶性黑色素瘤,尚无应用于其他肿瘤的成功案例。此外,该技术在全世界都属于研究阶段,远未上市。
4.7 CTL:聚焦病毒感染相关的癌症
CTL(cytotoxic T lymphocytes)技术。它的核心理念:对血液里的淋巴细胞,进行“大海捞针”似的严格筛选,将其中真正能杀伤肿瘤的极少数“精英战士”挑选出来,然后进行体外改良、扩增和活化。
CTL技术与CIK、DC-CIK技术,最核心的区别:CIK、DC-CIK技术将来自病人外周血中的某一类或某几类淋巴细胞,都进行了培养和扩增,其中的绝大多数不能识别癌细胞,真正能抗癌的淋巴细胞所占的比例只有千分之一甚至百万分之一——也就是说组织了一个县的民兵去前线杀敌,结果发现只有几个人掌握了武器的使用方法,其他绝大多数人都是“不明真相”的“吃瓜群众”;
CTL技术,则完全相反,是利用癌细胞特有的、正常细胞上没有或者含量很低的蛋白质做诱饵,把外周血中那“万里挑一”的真正能抗癌的淋巴细胞,挑选出来,然后在体外进一步改良和扩增,然后回输给患者。
4.8 CAR-T: 血液肿瘤效果不错
CAR-T(chimeric antigen receptor-T cells)原来,淋巴细胞要杀伤癌细胞的前提,是要从正常细胞中区别出癌细胞;否则格杀勿论,岂不是整个人都要和癌细胞同归于尽了。
淋巴细胞要想高效率地找到癌细胞,前提是癌细胞上有一些区别于正常细胞的标记,而淋巴细胞上有能识别这些特殊标记的装置。
CAR-T技术,就是利用转基因技术给淋巴细胞安装独特的“照妖镜”,拥有了“照妖镜”,淋巴细胞就能迅速、准确地识破“披着羊皮的狼”,并对它们发动猛烈的攻击。
但是,由于涉及到转基因技术,转入的基因还是人工设计的,所以,关于CAR-T技术的安全性,一直争议不断。
CAR-T技术,给淋巴细胞安装的“照妖镜”是人工设计的,有可能出现可怕的副作用。想当初,Emily回输了CAR-T细胞后,几天内就爆发了严重的炎症因子风暴(cytokine storm),濒临休克;后来,Carl June教授和他的团队,冒险给小姑娘使用了一种原本用来治疗类风湿性关节炎的药物(IL-6拮抗剂),才将小姑娘从死亡的边缘挽救回来。
4.9 TCR-T
从其他地方“借”一个天然产生的“照妖镜”,“嫁接”到淋巴细胞上,或许更安全——这就是TCR-T(T cell receptor-T cells)技术:和CAR-T一样,它也需要转基因;不同的是,TCR-T转入的基因,是自然界天然产生的;而CAR-T,转入的基因是人工设计的。
TCR-T相比于CAR-T,优势是安全性更高,劣势是TCR-T需要像骨髓移植一样,首先配型;然后,还要检测患者肿瘤组织中特定蛋白质的表达。只有相应的特定蛋白质高表达,而且配型合适的病友,才能使用,否则没有效果。
4.10 Neoantigen:“私人订制”的肿瘤免疫治疗
这种“私人订制”的肿瘤免疫细胞治疗新技术,目前只有屈指可数的成功案例。
2014年,Steven Rosenberg教授报道了第一例利用neoantigen技术,治疗晚期胆管癌的成功案例,患者肿瘤完全缓解。
2016年底,同一团队又报道了一例利用该技术,治疗携带KRAS基因突变的晚期结直肠癌的案例。
此后,他们又系统地评估了多种消化道肿瘤(肝癌、食管癌、结直肠癌、胰腺癌、胆囊癌、胆管癌等)实施该技术的可行性。
他们发现:绝大多数癌症患者,理论上讲,都有可能从中获益,相关的临床试验正在设计中。
不过,说句实在话,这种豪华版黑科技,估计最终只能是限量版。
- Tran E,TurcotteS,GrosA, et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelialcancer.Science. 2014 May 9;344(6184):641-5.
- Tran E,AhmadzadehM, Lu YC, et al. Immunogenicity of somatic mutations in human gastrointestinalcancers.Science. 2015 Dec 11;350(6266):1387-90.
- Ton N. Schumacher and Robert D. Schreiber.Neoantigensin cancerimmunotherapy.science. Science. 2015.348.6230: 69-74
- Rosenberg SA, Tran E, Robbins PF. T-Cell Transfer Therapy Targeting Mutant KRAS. NEnglJ Med. 2017 Feb 16;376(7):e11
从突变到新抗原:肿瘤与免疫系统之间的一场豪赌!
突变是肿瘤发生的开始,然而肿瘤细胞通过累积突变获得生存或生长优势的同时,也可能是“自我毁灭”的开始
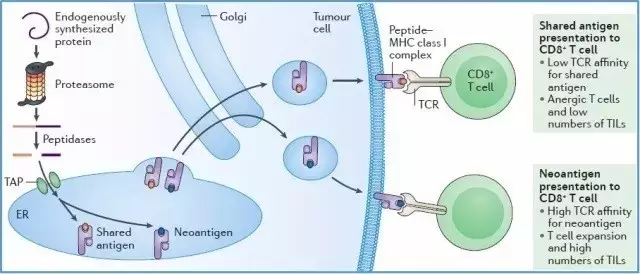
突变有可能是“非同义突变(nonsynonymous mutations)”,会改变氨基酸编码序列,导致肿瘤细胞表达正常细胞所没有的异常蛋白。
这些异常蛋白,如果在细胞内(肿瘤细胞或APCs)被降解成短肽段(抗原表位),与MHC-I类或MHC-II类分子高亲和力结合,并以复合物形式呈递到细胞表面,被T细胞识别为“非己(non-self)”,引起T细胞活化,进而肿瘤细胞被效应T细胞攻击和清除
这种会引起T细胞活化的异常蛋白即我们所称的“新抗原(neoantigen)”,能够产生新抗原的突变即为具有免疫原性的突变(immunogenic mutation)。
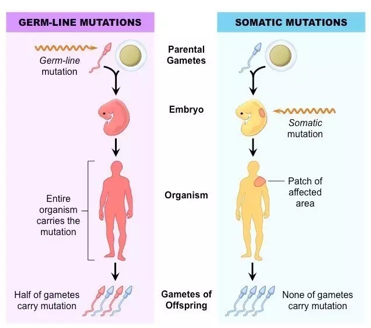
肿瘤突变负荷(tumor mutation burden, TMB):肿瘤基因组去除胚系突变(germline mutation)后的体细胞突变数量(somatic mutation)
TMB越高,最后能够被T细胞识别的新抗原产生也越多。
TMB>10/1Mb的黑色素瘤,经常会产生新抗原(frequently),对PD-1/PD-L1抑制剂敏感,这是黑色素瘤对PD-1/PD-L1抑制剂效果更好的原因之一;
很大一部分肿瘤TMB> 1/1Mb,< 10/Mb,能够产生新抗原(regularly),对PD-1/PD-L1抑制剂可能敏感,有些需要联合治疗来增加新抗原的产生。例如在临床上,不经过筛选,确实也看到了NSCLC一部分患者对PD-1/PD-L1抑制剂有效;
而肿瘤TMB<1/Mb,几乎不太可能产生新抗原(occasionally),对PD-1/PD-L1抑制剂不敏感。
4.11 免疫检查点疗法
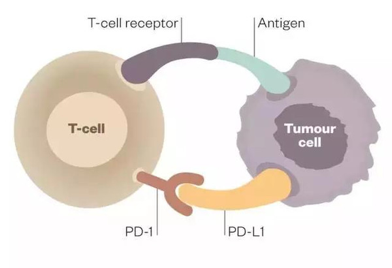
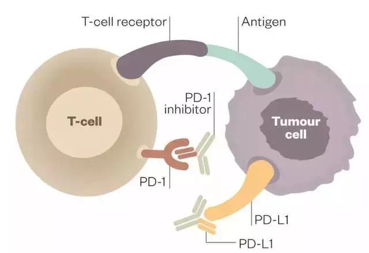
何为免疫检查点分子 immune checkpoint molecules?
人体的免疫功能受到激发时会活化,但不会过度活化,“免疫检查点分子”的重要功能之一就是类似汽车的刹车系统,在免疫系统活化时能够及时“刹车”,使免疫系统的活化保持在正常的范围之内,这样,免疫系统就不会过度活化。

目前用于此类治疗的靶点有很多,研究最热门的是CTLA-4(cytotoxic T lymphocyte associated antigen 4 )、PD-1/PD-1L(programmed cell death 1 )
CTLA-4(又称CD152),是表达在T细胞表面的细胞毒性T淋巴细胞相关蛋白,当其和抗原提成细胞(APCs)表面的CD80(B7-1)和CD86(B7-2)结合时,可使T细胞失活,因此通过抑制性抗体抑制CYLA-4可以阻断这一机制,进而增强T细胞的活性。
FDA已经批准了两个抗CTLA-4抗体,分别是百时美施贵宝的Yervoy(ipilimumab)以及辉瑞的tremelimumab,用于黑色素瘤以及间皮瘤的治疗。
靶向PD-1/PD-L1的免疫疗法是当前最受瞩目的新一类抗癌免疫疗法,旨在利用人体自身的免疫系统抵御癌症,通过阻断PD-1/PD-L1信号通路激发机体的抗肿瘤免疫功能。
美国FDA已批准了4个免疫检查点抑制剂,分别为百时美施贵宝的PD-1单抗Opdivo(Nivolumab)、默沙东的PD-1单抗Keytruda(Pembrolizumab)、罗氏的PD-L1单抗Tecentriq(Atezolizumab)、默克&辉瑞的PD-L1单抗Bavencio(avelumab),用于治疗晚期黑色素瘤、非小细胞肺癌、肾癌、霍奇金淋巴瘤、头颈部鳞状细胞癌、膀胱癌以及转移性梅克尔细胞癌(一种非常罕见的皮肤癌)等,对于多种其他肿瘤如肝癌、肠癌等的临床试验正在进行中。
4.12 巨噬细胞免疫疗法
4大类
修复巨噬细胞的抗肿瘤活性:目前主要的方向是靶向CD47-SIRPα通路。
减少肿瘤微环境中的M2型巨噬细胞:目前主要的研究方向是抑制CSF-1-CSF-1R通路。
抑制肿瘤位置的巨噬细胞招募:目前主要的研究方向是阻断CCL2-CCR2通路。
将M2型巨噬细胞重编程为MI型巨噬细胞:目前主要的研究方向是CD40激动剂抗体。
European Journal of Cancer 76 (2017) 100-109
Current Opinion inPharmacology 2015, 23:45–51